政策、技术与需求驱动我国干细胞行业发展
时间:2020-06-12
A-
A+
2016年,中国公布首批30家干细胞临床研究机构,2019年起干细胞临床研究机构与项目备案将实行动态管理,截止到2019年9月,国家批准干细胞临床治疗研究医院增至106家,军队系统的医院批准的共12家,一共118家机构;备案项目增至62个,文献研究专利申请不断增长。截止到2020年3月,在 ClinicalTrial.gov 上注册的干细胞相关临床研究已达5432项,其中中国有469项,较多开展的城市为广州、 北京、上海。
全球干细胞产业政策松紧不一,北美、欧洲较为活跃。美国自奥巴马登台一个月就放开了胚胎干细胞研究,FDA设立了快速审批通道,鼓励临床医学家快速占领干细胞临床治疗的制高点,跨国企业加大投入纷纷布局干细胞产业链。2015 年之后,我国在政策上加大支持力度,从规范监管、技术支持以及资金三个方面促进行业的发展;在技术上,干细胞一直处于研究热点,不断取得突破;需求推动是干细胞行业发展的根本原因,白血病、艾滋病、糖尿病等一系列医学难题有望通过干细胞的临床应用得到解决。
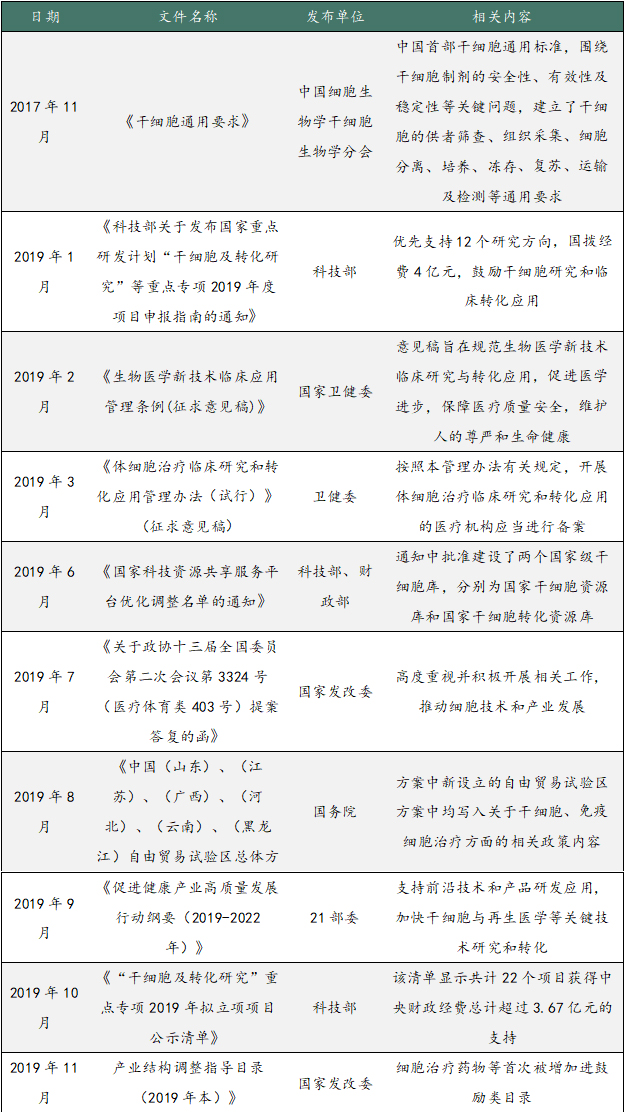
近年来,国家干细胞产业支持政策不断升级,干细胞临床应用将步入高速规范发展期,具体政策见下表。在监管模式上采用“双轨制”,即根据产品的属性以“第三类医疗技术”或者“新药”的名义申报进入临床试验。“第三类医疗技术”主要针对自体成体干细胞、供受者一对一的异体成体干细胞,由卫健委负责管理;“新药”主要针对一供体对应两个以上受体的成体干细胞,由NMPA负责管理。
全球研发暗潮涌动,奇点突破在即,我国研究水平世界领先。技术创新是干细胞行业发展的核心驱动力,是改变国内中下游产业链薄弱现状的主要途径,全球都在通过多种方式进行干细胞及相关产品研发,积极转化干细胞研究成果。
2016年,中国公布首批30家干细胞临床研究机构,2019年起干细胞临床研究机构与项目备案将实行动态管理,截止到2019年9月,国家批准干细胞临床治疗研究医院增至106家,军队系统的医院批准的共12家,一共118家机构;备案项目增至62个,文献研究专利申请不断增长。截止到2020年3月,在 ClinicalTrial.gov 上注册的干细胞相关临床研究已达5432项,其中中国有469项,较多开展的城市为广州、 北京、上海。
随着干细胞技术的飞速进展,我们在中国境内展开试验的申请人中也看到了世界药企巨头的身影,包括拜耳、新基、葛兰素史克、辉瑞等。在诸多疾病领域,中国也获得了进展,如干细胞治疗骨关节炎、糖尿病足、急性心肌缺血、地中海贫血、帕金森症等。
当前干细胞的基础研究领域主要在以下几个方面:细胞重编程研究、干细胞自我更新及多能性维持的机理研究、新型的多能干细胞研究和干细胞定向诱导分化及其调控机制研究。