干细胞是人体内一种尚未分化的细胞,具有极强的分化和再生能力。通过研究人类干细胞模型,可帮助研究疾病的治疗。Aicardi-Goutieres综合征(AGS)是一种罕见但致命的遗传性自身免疫性疾病,其临床特征包括炎症标志物和其他炎症反应增加,类似于婴儿在子宫内获得的出生前病毒感染。早期研究表明,对细胞免疫反应调节来说,AGS患者缺少正常的关键核酸代谢基因,其中一种有助于防止DNA异常积聚的TREX1酶生产不足。
干细胞是人体内一种尚未分化的细胞,具有极强的分化和再生能力。通过研究人类干细胞模型,可帮助研究疾病的治疗。Aicardi-Goutieres综合征(AGS)是一种罕见但致命的遗传性自身免疫性疾病,其临床特征包括炎症标志物和其他炎症反应增加,类似于婴儿在子宫内获得的出生前病毒感染。早期研究表明,对细胞免疫反应调节来说,AGS患者缺少正常的关键核酸代谢基因,其中一种有助于防止DNA异常积聚的TREX1酶生产不足。
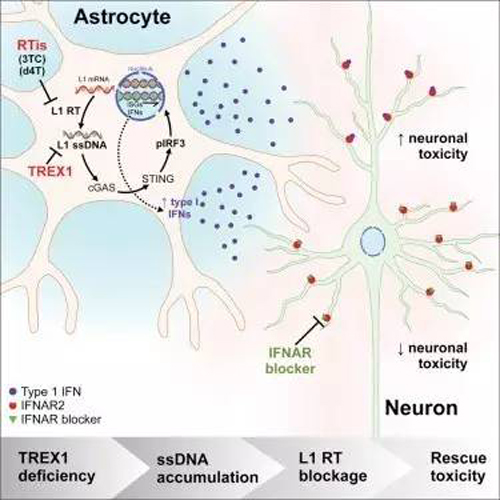
AGS发病机制的深入研究开展一直十分困难,因为动物模型无法准确地模拟这种人类疾病。近日,来自加州大学圣地亚哥分校的研究人员Muotri和他的同事们用胚胎干细胞(ES细胞)和来自患者身上的诱导多能干细胞(iPS细胞)成功创建了AGS细胞模型,并利用人工构建的人类干细胞模型发现了抑制疾病进程的已知药物。
研究人员发现,TREX1功能不正常后所有细胞模型都出现了多余的染色体外DNA,它们主要来自LINE1 (L1)逆转录因子。L1是一类重复DNA序列,可在人类基因组中自发地“复制-粘贴”自己,在过去它们被称为“垃圾基因”,它们在细胞内的功能很大程度上仍然未知。在Muotri实验室创造的一些AGS干细胞模型中,多余DNA产生了毒素。另一些模型表现出了异常的免疫反应,分泌毒素让其他细胞死亡。“综合了这些影响的类器官的神经元生长急剧减少,这些模型似乎是胎儿发育时期的AGS发病进展的一面镜子,在本应进行神经发育的阶段,细胞出现死亡和减少。”Muotri说。相反,敲低L1基因后可以显著降低对细胞的毒性。由于研究人员观察到的AGS发病特征与逆转录病毒感染相似,于是他们想看看现有的抗HIV逆转录病毒药物是否能影响L1复制。他们选取了两种药物:Stavudine和Lamivudine。结果显示,两种药能都减少模型干细胞的L1水平和细胞毒性,构成类器官的各种复杂神经细胞群又因细胞模型得以生长而重焕生机。相关的临床试验正准备在欧洲开展。
两种FDA批准药物在检测过程中表现出众,这一发现不仅具有临床应用价值,在基础科研层面,它预示着没有其他模型可用时,人们可以创建新型的以干细胞为基础的疾病模型。
人成体干细胞中,牙髓干细胞的活性最强,可达其他来源干细胞的三倍以上。间充质干细胞可有效干预200余种疾病的治疗,也可用于器官和组织的再造。


