干细胞在子宫内膜再生修复中发挥重要作用!
时间:2019-06-17
A-
A+
子宫内膜再生修复障碍主要是由于子宫内膜肌底层受损所致。有文献报道子宫内膜基底层存在着子宫内膜干细胞,它是子宫内膜再生修复的来源。在正常的月经循环周期中子宫内膜干细胞可分化为上皮细胞和间质细胞及血管的功能层,并受激素的影响周期性的脱落,从而激活基底层的子宫内膜干细胞,进行自我的更新、增殖及分化修复子宫内膜。
在女性的生育期里,子宫每个月都会脱落并再生内膜组织,为怀孕或下一个周期做准备。人类生殖这一古老而重要的部分背后的过程尚未得到很好的理解。但是最近由耶鲁大学病理学家Wang Min领导的研究发现,干细胞和一种基因参与了这个每月一次的活动。
间充质干细胞(MSC)是中胚层早期发展中形成的多能成体干细胞,具有强大的分化潜能和自我更新的能力,在特定诱导条件下可向脂肪细胞、骨细胞、软骨细胞分化,甚至可跨胚层向神经细胞、肝细胞、胰岛细胞分化等。同时间充质干细胞广泛分布于多种器官组织如骨髓、脐带、羊膜囊、肌肉、肝脏等,取材方便、易分离、体外易培养、增殖速度快、低免疫性、低成瘤性、免疫调节等特点,成为组织器官再生修复的新来源。
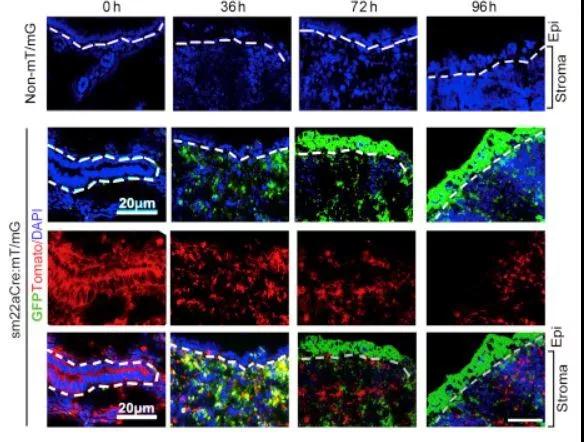
子宫内膜再生修复障碍主要是由于子宫内膜肌底层受损所致。有文献报道子宫内膜基底层存在着子宫内膜干细胞,它是子宫内膜再生修复的来源。在正常的月经循环周期中子宫内膜干细胞可分化为上皮细胞和间质细胞及血管的功能层,并受激素的影响周期性的脱落,从而激活基底层的子宫内膜干细胞,进行自我的更新、增殖及分化修复子宫内膜。
我们都知道,子宫内膜可分化为功能层和基底层。功能层由柱状上皮腺体和疏松的基质组成,是胚胎植入的部位,受卵巢激素的调节,发生周期性增殖、分泌、脱落的变化;基底层由腺体的根部和致密的基质组成,不受卵巢激素的影响,在月经后再生并且修复子宫创面,重新形成子宫内膜功能层。
一旦子宫内膜基底层受损造成子宫内膜干细胞减少甚至缺失,导致子宫内膜发育不良,再生修复障碍,其病理征可表现为腺上皮生长缓慢、子宫动脉血流高阻力,血管发育不良,血管内皮生长因子的低表达的薄型子宫(子宫内膜厚度<7mm;严重者可在基底层损伤区域形成上皮细胞和间质细胞被纤维细胞所替代,发生病理性改变,产生大量纤维结缔组织造成宫腔粘连(intrauterine adhesion,IUA),最后导致子宫失去正常形态和功能。
当前针对 IUAs 的治疗主要的是宫腔镜下粘连分离,术后应用激素、放置节育器或其他支撑材料、置入生物胶等手段以防止粘连再形成,但重度 IUAs 治疗后再复发率仍高达。因此,急需探索新的方法以重建和修复 IUAs 患者的子宫内膜,降低复发率,改善患者妊娠结局及月经状况。
由于干细胞可分泌许多促进血管生成的细胞因子和生长因子VEGF,在心肌梗死和脑血管闭塞的研究中都发现,间充质于细胞可以分泌许多血管生成相关因子,促进血管新生,抑制纤维化和细胞凋亡,改善心肌缺血、脑缺血状态,从而起到组织器官损伤修复的作用。在大鼠宫腔粗连模型试验中发现,宫角部原位注射脂肪来源的间充质干细胞能够增加内膜VEGF表达、促进血管新成、抑制纤维化。
值得关注的是,南京鼓楼医院的胡娅莉团队与其合作通过提取患者自身干细胞,附着在可降解的生物支架材料上,用支架材料的孔隙和干细胞的分化功能完成血管组织的再生,结合传统宫腔镜的改进,实现了受损子宫内膜的功能性修复。有病人相继怀孕并顺利生产,目前这项研究仍在继续。这是干细胞在世界再生医学领域的重要成果,也是在生殖领域的成功突破。

