干细胞治疗糖尿病微血管循环病变
时间:2020-11-05
A-
A+
通过科研人员正不断努力,利用干细胞来治疗糖尿病及其并发症的临床研究也正在广泛开展,相信未来,更多的糖尿病患者会受益于此项技术!
糖尿病已成为世界上发病率最高、对人类健康威胁最严重的疾病之一,在全球人口全因死亡因素中,糖尿病已成为第七位独立因素。目前我国糖尿病患者总数已经超过1.1亿,城镇20岁以上人口的糖尿病患病率达到9.7%。由于患者胰岛素分泌障碍或胰岛素不能发挥生理作用出现糖代谢紊乱,导致大血管和微血管病变,引起肢体坏死、失明、肾功能障碍和动脉粥样硬化等一系列严重的并发症。这些并发症是糖尿病患者致残或致死的主要原因。目前仍不能有效地防止或逆转糖尿病引起的微血管病变,因此糖尿病微血管病变的发病机制一直是当今医学研究的热点,也是防治糖尿病并发症的关键。
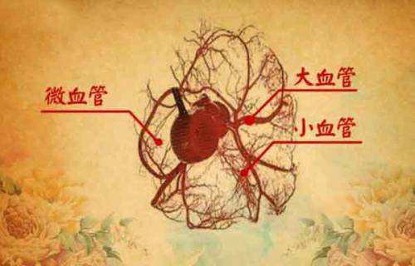
糖尿病的微血管病变主要包括视网膜血管病变引起的视力障碍、周围血管病变产生的糖尿病周围神经病变和肾小球微血管病变导致的肾功能障碍。
糖尿病微血管病变
随着糖尿病诊治水平的提高,患者的生存期、病程延长,相应的糖尿病微血管病变的发病人群日趋庞大。目前,糖尿病微血管并发症已成为慢性肾病、失明、糖尿病足的主要原因。
干细胞治疗糖尿病肾病
糖尿病肾病是严重的糖尿病并发症之一,约1/3的1型糖尿病和25%的2型糖尿病最终发展为糖尿病肾病。在国内,2011年糖尿病肾病已超过肾小球肾炎成为终末期肾病的主要病因。糖尿病肾病早期出现肾小球肥大、基底膜增厚以及系膜区细胞外基质进行性积聚,尿蛋白排泄量增加(30-300mg/天),后期表现为肾小球和肾小管间质的纤维化,大量蛋白尿生成(﹥300mg/天),发生终末期肾功能衰竭。再生修复治疗策略应该越早期介入越能显现出重要的作用。
在糖尿病肾病动物模型实验研究中,间充质干细胞(MSC)治疗能够减轻肾脏细胞损伤、降低尿微量白蛋白水平、改善肾脏特异组织学病理改变[1,2],细胞水平机制研究证明,MSC通过免疫调节、抗炎、抗凋亡、抑制纤维化发挥其治疗效应,MSC分泌的营养性因子和微囊泡抑制氧化应激、减轻炎性反应、抑制过度免疫应答、促进肾组织细胞增值抑制凋亡,改善糖尿病肾病肾功能;全球相关临床研究已结束14项,其中与糖尿病肾病类似的NCT01840540是动脉粥样硬化肾血管病28例患者的临床研究,MSC治疗改善双侧肾脏血供,肾小球滤过率不再进行性衰退。2016 年获批的NCT02585622研究是一项异体骨髓间充质干细胞治疗糖尿病Ⅰ/Ⅱ期临床研究,正处于患者招募中,预计2020年底结束。
干细胞治疗视网膜病变
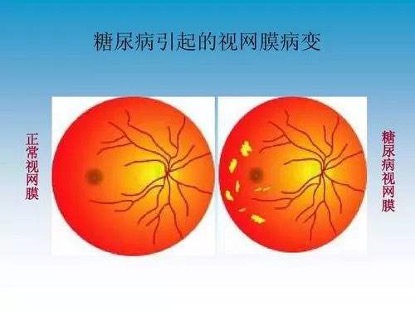
糖尿病视网膜病变
在我国,糖尿病视网膜病变(DR)是导致患者视力下降的主要眼病之一,其发病率和致盲率随病程和年龄的增长呈逐年上升趋势。病程和血糖的控制水平是影响DR进展的主要因素。研究提示高血糖、高血脂、高血压以及饮酒、吸烟是糖尿病微血管并发症的危险因素。糖尿病病程10-14年者26%发生DR,病程15年以上发生率为63%。我国糖尿病患者中DR总患病率为44%-51%[3]。
DR是视网膜组织发生闭塞性、渗漏性和增殖性的微血管病变,治疗策略包括药物、激光和手术治疗,但现有的治疗未能有效保护血管和神经,进而控制疾病进展。MSC再生潜能吸引了研究者对其在糖尿病视网膜眼病治疗的极大兴趣。临床前动物模型研究显示,视网膜下移植MSC有阻断眼底蜕变的作用,玻璃体内注射移植以及静脉输注可减轻视网膜血管渗出、抑制血管凋亡、闭塞,视网膜电图恢复正常,但玻璃体内移植可引起细胞骨化或纤维样增生 (Nolta J, Pugh E, Zawadzki R, personal communication, 2015),因此,玻璃体移植安全性需要进一步观察[4-7]。基于临床前研究结果,2017年clinicaltrials gov注册骨髓源MSC治疗糖尿病眼病临床Ⅰ/Ⅱ研究(NCT03011541)。
结语
目前,已有越来越多的科学研究成果证实了干细胞疗法治疗糖尿病肾病和视网膜病变的有效性,科学家们也构建了大量的动物模型进行实验,探索出了各类以干细胞为基础的方法,显著改善肾功能及视网膜病变,临床研究也在逐步探索。通过科研人员正不断努力,利用干细胞来治疗糖尿病及其并发症的临床研究也正在广泛开展,相信未来,更多的糖尿病患者会受益于此项技术!
声明:本平台部分及文字、图片来源于网络,版权归属于原作者所有。转载的文章其原创性以及文中陈述文字和内容未经本微信平台证实,对其中全部或者部分内容、文字的真实性、完整性、及时性本平台不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。如有侵权请联系小编撤稿。
参考文献
1. Lee RH, Seo MJ, Reger RL, etal. Multipotent stromal cells from human marrow home to and
promote repair of pancreatic islets andrenal glomeruli in diabetic NOD/scid mice. Proc Natl Acad Sci USA 2006,103(46):17438-17443.
2. Ezquer FE, Ezquer ME, ParrauDB, et al. Systemic administration of multipotent mesenchymal
stromal cells reverts hyperglycemia andprevents nephropathy in type 1 diabetic mice. Biol Blood Marrow Transplant2008, 14(6):631-640.
3. 葛坚,王宁利。眼科学[M].3版,北京,人民卫生出版社,2015:332
4. Yang Z, Li K,Yan X, Dong F, Zhao C. Amelioration of diabetic retinopathy by engrafted human adipose-derived mesenchymal stem cells in streptozotocindiabetic rats. Graefes Arch Clin Exp Ophthalmol. 2010;248:1415–1422.
5. Traktuev DO,Merfeld-Clauss S, Li J, et al. A population of multipotent CD34+ adipose stroma cells share pericyte and mesencymal surface markers,reside in a periendothelial location, and stabilize endothelial networks. Circ Res.2008;102:77–85.
6. Mendel TA,Clabough EB, Kao DS, et al. Pericytes derived from adipose-derived stem cells protect against retinal vasculopathy. PLoS One.2013;8:e65691
7. KimbrelEA, Kouris NA, Yavanian GJ, et al. Mesenchymal stem cell population derivedfrom human pluripotent stem cells displays potent immunomodulatory andtherapeutic properties. Stem Cells Dev. 2014;23:1611–1624